Термометры и температурные шкалы появились для того, чтобы определять численную величину внутреннего состояния вещества, связанного с тепловой энергией.
То есть определять насколько вещество тёплое или холодное. Или точнее, сколько порций тепловой энергии, равной удельной теплоёмкости каждая, поглощено или излучено каждой единицей массы вещества от точки таяния льда.
Что такое температура? Измерение температуры. Связь энергии с температурой.
Сначала о том, что говорится об этом в учебниках по “современной” физике. Температура – фундаментальная физическая величина, характеризующая состояние термодинамического равновесия системы.
В качестве интерполяционного прибора для области температур от 13,81К до![]() применяют платиновый термометр сопротивления.
применяют платиновый термометр сопротивления.
Теперь рассмотрим эти вопросы в свете новой концепции.
Температура – это одна из характеристик внутреннего состояния вещества. Температура связана с тепловой энергией.Она представляет собой количество тепловой энергии в единице массы вещества, определяемой в особых единицах, названных градусами (градусы Реомюра, Фаренгейта, Цельсия и другие). Переносчиками тепловой энергии являются фотоны инфракрасного диапазона. Тепловая энергия – это результат взаимодействия фотонов инфракрасного диапазона с внешними электронами атомов и молекул вещества. Присваивать характеристику температуры самим фотонам электромагнитного излучения не имеет физического смысла. Фотоны не вещество. Фотоны только лишь переносчики электромагнитной энергии. Соответственно, не имеет физического смысла характеризовать температурой ионизированный газ, плазму, нейтронное вещество и вещество “чёрной дыры”, которые не имеют структуры обычного вещества с внешними электронами или внешние электроны ионизированы.
Рассмотрим связь тепловой энергии с температурой, когда все процессы происходят вне звёздного вещества.
Доставляя нам энергию от звёзд (Солнца), фотоны взаимодействуют с веществом по-разному, в зависимости от частотного диапазона. Если вещество поглощает фотоны инфракрасного диапазона, то вещество нагревается. При этом происходят процессы поглощения фотонов этого частотного диапазона внешними электронами атомов и молекул вещества. Размеры атомов и молекул увеличиваются за счёт перемещения внешних электронов на более удалённые орбиты от ядра. Размеры газообразных, жидких и твёрдых тел при этом будут увеличиваться. При излучении фотонов внешними электронами размеры атомов и молекул будут уменьшаться за счёт перемещения внешних электронов на более близкие к ядру орбиты. При этом размеры газообразных, жидких и твёрдых тел будут уменьшаться. Всё это соответствует постулатам Н. Бора. Работа жидкостных термометров основана на этих процессах.
Только когда фотоны инфракрасного диапазона излучены или поглощены внешними электронами атомов и молекул вещества, можно говорить об изменении температуры тела. Температура в веществе характеризуется размерами орбит внешних электронов атомов и молекул для данного вещества. Так как фотоны инфракрасного диапазона всё время переизлучаются внутри тела, поэтому о температуре тела можно судить лишь как о средневероятностной величине. Естественно, говорить о температуре отдельного атома или молекулы не имеет физического смысла.
Самая низкая температура вещества наступает, когда внешние электроны атомов или молекул находятся на орбитах минимально близких от ядра. Самая высокая температура вещества наступает, когда внешние электроны атомов или молекул находятся на орбитах максимально удалённых от ядра.
Теперь рассмотрим связь тепловой энергии с температурой, когда все процессы происходят внутри звёздного вещества. Все светящиеся звёзды состоят из плазмы.
Плазма – это ионизированный газ, в котором объёмные плотности положительных и отрицательных электрических зарядов практически одинаковы, а концентрация заряженных частиц сравнительно велика. Но это ещё не всё в определении плазмы.
Модель вещества в состоянии плазмы такова. Атомы химических элементов, то распадаются при поглощении фотонов, то вновь рекомбинируют при их излучении. При этом скорость этих процессов такова, что вещество не успевает сжаться до плотности нейтронного вещества, то есть атомы сохраняют свой объём в пространстве.
Состояние вещества в виде плазмы отличается от других состояний вещества: газообразного, жидкого и твёрдого. Одно из отличий – это связь вещества с тепловой энергией и измерение температуры вещества.
И самое главное в определении плазмы. Вещество в состоянии плазмы представляет собой генератор мощности излучения, а не абсолютно чёрное тело, как утверждали Стефан и Больцман. То есть внутри плазмы всё время имеется избыток фотонов, который всё время излучается. Источником мощности излучения может быть термоядерный синтез химических элементов, электрические поля у молнии, пламя при химической реакции окисления и др.
Считается, что образуется плазма, в том числе, при нагревании газа до температур, достаточной для термической ионизации. Однако, это не совсем так. Кончился нагрев, вещество остыло, так как отсутствовал генератор мощности излучения. Не путайте ионизированный газ (вещество) с плазмой. Это разные процессы и, соответственно, состояния вещества.
Характеризовать состояние вещества в виде плазмы температурой нельзя. То, что Реомюр и Цельсий изначально назвали температурой, для данного случая не подходит. То определение абсолютно чёрного тела, которое дал Планк, к плазме никакого отношения не имеет. Температура – это особая единица измерения внутреннего состояния вещества, связанная с тепловой энергией. Если состояние вещества таково, что оно может, как поглощать, так и излучать тепловую энергию, то это состояние вещества можно характеризовать температурой. У плазмы это невозможно. Плазма только излучает. Поэтому плазму можно характеризовать: спектром излучения, максимальной длиной волны излучения (цвет), мощностью и интенсивностью излучения. Интенсивность излучения плазмы не связана с цветом (“температурой”). При одном данном цвете интенсивность излучения может быть различной и прямой зависимости с цветом не имеет. Солнце, например, посылает нам то больше, то меньше энергии при одном цвете (“температуре”).
Все светящиеся звёзды состоят из плазмы. Какова “температура” звёздного вещества (плазмы)? Считается, что измерить “температуру” звёздного вещества можно только у внешних слоёв и только бесконтактным способом с помощью цвета (пирометром). “Температуру” внутренних слоёв звезды, ни каким способом не измерить. Информацию об излучающей поверхности звезды (Солнца) можно зарегистрировать только через излученные фотоны. При рекомбинации электроны излучают фотоны, которые мы регистрируем. Считается, что, якобы измерив “температуру” излучающей поверхности Солнца (с помощью пирометра), можно по формуле Стефана-Больцмана рассчитать интенсивность излучения поверхности Солнца.
Однако это не так. Формула Стефана-Больцмана ![]() ошибочна. “Выведена” она без эксперимента методом статистической физики, где Солнце представляется как абсолютно чёрное тело. Плазма и абсолютно чёрное тело – это как бы антиподы. Абсолютно чёрное тело – это процесс равновесия, как излучения, так и поглощения. Плазма только излучает. Плазма не может поглощать. Подумайте, что может поглощать плазма согласно второму началу термодинамики.
ошибочна. “Выведена” она без эксперимента методом статистической физики, где Солнце представляется как абсолютно чёрное тело. Плазма и абсолютно чёрное тело – это как бы антиподы. Абсолютно чёрное тело – это процесс равновесия, как излучения, так и поглощения. Плазма только излучает. Плазма не может поглощать. Подумайте, что может поглощать плазма согласно второму началу термодинамики.
Фотоны и нейтрино в звезде (Солнце) появляются в результате реакций термоядерного синтеза. Каждый тип реакции связан с появлением нового химического элемента. При этом для каждого типа реакций термоядерного синтеза свойственно излучение фотонов и нейтрино строго определённых частот (масс, энергий). Естественно, что одновременно происходит множество типов реакций термоядерного синтеза, в результате которых образуются разные химические элементы. Дальнейшая жизнь фотонов – это сплошные переизлучения электронами атомов химических элементов, пока фотоны не достигнут верхних слоёв звезды и не излучатся в космическое пространство. Однако с каждым переизлучением частота (масса, энергия) фотонов будет изменяться. Это будут уже другие фотоны, отличающиеся от первоначальных. Каких первоначальных, именно, трудно предположить. Но точно можно сказать, что с возрастом звезды как фотоны от термоядерного синтеза, так и фотоны, излученные поверхностью звезды, будут с более низкой частотой (массой, энергией), чем предыдущие.
Энергия от звёзд (Солнца) достигшая поверхности Земли будет тепловой только при взаимодействии вещества с инфракрасным диапазоном. Её можно характеризовать температурой.
При взаимодействии фотонов других диапазонов (радиодиапазона, видимого, ультрафиолетового, рентгеновского) с веществом, вещество не нагревается и не расширяется. Значит, это не тепловая энергия. Называть её необходимо по-другому и не присваивать характеристику температуры.
Теперь об измерении температуры.
Рассмотрим вопрос: какой внутренней энергией обладает вещество?
Во-первых, вещество обладает энергией подвижности атомов и молекул, средняя кинетическая энергия которой величина постоянная (глава 1, разделы 24, 25, 26).
Все атомы и молекулы в веществе в каждый момент времени обладают разными значениями величины кинетической энергии и имеют различные направления движения. Атомы и молекулы очень маленькие, их очень много – в каждом грамм-моле вещества и движутся они хаотично в разных направлениях. Суммарный вектор их движений равен нулю. Исходя из этого, среднюю кинетическую энергию атомов и молекул определить невозможно. Можно только сказать, что средняя кинетическая энергия подвижности атомов и молекул величина постоянная, не зависящая ни от чего-либо (глава 1, раздел 24, 25).
Во-вторых, вещество обладает тепловой энергией, которую мы связываем с температурой и которая может изменяться.
Также как и в первом случае, атомов и молекул в веществе очень много. Все они то поглощают, то излучают тепловые фотоны, которые являются переносчиками тепловой энергии.
Чтобы измерить тепловую энергию газообразного, жидкого или твёрдого вещества необходимо сосчитать массу переносчиков тепловой энергии (фотонов инфракрасного диапазона электромагнитных волн) в единице исследуемой массы вещества.
где: ![]() — сумма масс всех фотонов инфракрасного диапазона электромагнитных волн в единице массы вещества,
— сумма масс всех фотонов инфракрасного диапазона электромагнитных волн в единице массы вещества,
С — скорость света.
Однако сделать это невозможно. Остаётся один способ (как и в случае определения массы тела – сравнение его массы с массой эталона) – это сравнение состояния исследуемого вещества с состоянием другого вещества, например, жидкостью находящейся в термометре. Тогда этот жидкостный термометр будет выступать в качестве эталона в определении температуры вещества (внутреннего состояния вещества).
Как это происходит? Поместим этот термометр в среду исследуемого вещества. Через какое-то время тепловые фотоны распределятся и в жидком веществе (например, подкрашенный спирт) термометра. По эффекту изменения объёма жидкости термометра мы сможем судить о тепловом состоянии исследуемого вещества.
А теперь надо рассмотреть вопрос о достоверности и точности, связанный с измерением температуры. Для измерения температуры пользуются температурными шкалами и некоторыми эффектами, происходящими с веществом при нагревании:
— изменение объёма жидких, твёрдых и газообразных веществ ![]() ;
;
— изменение электрического сопротивления веществ (термосопротивления) ![]() ;
;
— изменение электродвижущей силы (ЭДС) в термопарах термо-![]() и другие.
и другие.
Все перечисленные зависимости носят нелинейный характер. Теперь попробуем рассмотреть поподробнее температурные шкалы, например, Реомюра, Цельсия и Кельвина.
В 1730 году французский учёный Реомюр построил температурную шкалу. Он использовал две точки состояния одного вещества (воды). Точку таяния льда принял равной нулю. Точку кипения воды принял за 80. Интервал между ними поделил на 80 равных частей. Одна восьмидесятая этого интервала стала называться градус Реомюра . Измерение температуры внутри этого интервала носит интерполяционный характер. Вне этого интервала неизвестно какой. Реомюр первым изобрёл термометр с подкрашенным спиртом.
В 1742 году шведский учёный Цельсий также построил температурную шкалу. Он использовал тот же интервал между точками таяния льда и кипением воды. Однако он разделил этот интервал на 100 равных частей. Одна сотая этого интервала стала называться градус Цельсия .
Теперь о температурной шкале Кельвина.
В 1802 году французский учёный Гей-Люссак открыл закон изменения объёма данной массы газа в изобарном процессе.
Закон Гей-Люссака: при изобарном нагревании газа от относительное изменение его объёма пропорционально конечной температуре ![]() , где
, где ![]() — называется коэффициентом объёмного расширения газа.
— называется коэффициентом объёмного расширения газа.
При определении конечного объёма газа ![]() .
.
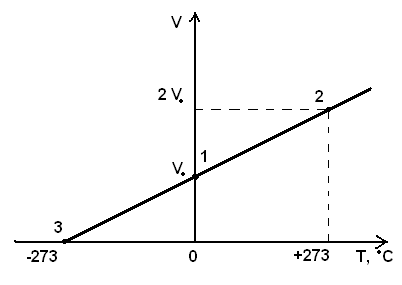
На основании этого в 1848 году английский физик Кельвин (1824 — 1907 г.) сделал следующее. Он построил график изобарного процесса для газа данной массы. По оси абсцисс он откладывал температуру, а по оси ординат — объём.
Это изображено на рис.10.
Как он рассуждал? Пусть при газ занимает объём ![]() . Начальное состояние газа обозначим точкой 1. Если нагреть этот газ до температуры , то его объём увеличится в два раза
. Начальное состояние газа обозначим точкой 1. Если нагреть этот газ до температуры , то его объём увеличится в два раза![]() .
.
Состояние нагретого газа отметим точкой 2.
Далее Кельвин рассуждал так. Так как по закону Гей-Люссака зависимость объёма газа от температуры при изобарном нагревании выражается линейно, то, соединив точки 1 и 2 прямой, получим изобару. Продолжим изобару влево до пересечения с осью температур в точке 3. Из подобия треугольников легко определить температуру газа в точке 3. Она получается равной . Английский физик посчитал, что это и будет самая низкая температура, и назвал её абсолютным нулём.
Рис.10
Так появилась шкала термодинамической температуры, в основе которой абсолютный нуль с температурой![]() . Градус Кельвина равен градусу Цельсия.
. Градус Кельвина равен градусу Цельсия.
Однако, точка 3 на рис.10 не может существовать физически. Объём газа, ни при какой температуре не может быть равным нулю. Какая бы низкая температура не была — минимальный объём газа всегда будет существовать.
Минимальный объём газа на рис.11 обозначим точкой 4. Через три точки 1, 2 и 4 проведём линию. Совершенно очевидно, что эта линия не прямая и она, естественно, не пересекается с осью абсцисс.
Эта кривая – гипербола. Это изображено на рис.11.
Тогда получается, что Кельвин ошибся. Шкала Кельвина ошибочная.
Об этом было ясно сказано в газовых законах Гей-Люссака и Шарля, которые начинаются словами: “при изобарном (или изохорном) нагревании газа от ![]() …”.
…”.
Гей-Люссак и Шарль считали, что их газовые законы действуют от ![]() и они линейны.
и они линейны.
Рис.11
Но они тоже ошибались. Их газовые законы не линейны не только при температурах ниже от , а при любых температурах. Однако при использовании интервала от до , кривую можно заменить прямой. Температура, измеренная в этом интервале, будет содержать определённую относительно небольшую методическую ошибку. Но вне этого интервала ошибка в измерении температуры будет существенной и неизвестно какой.
Рассмотрим, на что указывают участки гиперболы вне интервала от до . Участок гиперболы в области отрицательных температур указывает на то, что внешние электроны молекул газа излучают инфракрасные фотоны и перескакивают на орбиты максимально приближённые к ядру молекулы. Минимальное расстояние орбиты внешнего электрона до ядра молекулы говорит и о минимальном объёме газа. Когда у всех молекул газа орбиты внешних электронов расположатся на минимальных расстояниях от ядра молекулы – это и будет теоретический нуль температуры.
Участок гиперболы в области положительных температур вне интервала от до резко устремляется вверх и имеет ограничение по оси абсцисс. Это говорит о том, что физический смысл температуры постепенно исчезает. Линия ограничения на оси абсцисс указывает на то, что газ переходит в состояние плазмы. Оказывается, что плазму характеризовать температурой уже нельзя. Это привело к цепочке последующих ошибок. А, именно, следствием этого стало появление ошибочной формулы Стефана-Больцмана об интенсивности солнечного излучения.
Таким образом, шкала Кельвина ошибочна, при чём ошибка увеличивается с удалением от реперных точек, так как все измерители температур основаны на процессах, описываемых нелинейными функциями:
Все расчёты, в которые входит термодинамическая температура, численно не верны.
Шкала Фаренгейта, предложенная в 1724 году, вообще не содержит реперных точек, связанных с конкретными состояниями одного вещества (плавление, кипение).
В методе построения температурной шкалы может быть только две реперные точки (плавление и кипение) для одного выбранного вещества. Так, как это сделали Реомюр и Цельсий. Тогда все точки в промежутке от до для всех термометров являются интерполяционными. От этого зависит точность измерений в этом промежутке. Вне этого промежутка измерения температуры не носят интерполяционного характера. Там точность и достоверность другая, неизвестно какая. Так называемые вспомогательные реперные точки не имеют физического смысла. Особенно, это относится к бесконтактным способам измерения высоких “температур” излучающих поверхностей.
А существует ли на самом деле абсолютный нуль температуры и можно ли его определить?
Минимальная температура вещества получается, когда во всех атомах и молекулах внешние электроны располагаются на самых возможно близких орбитах от ядра. Каково численное значение температуры вещества по шкале Цельсия при этом?
Это неизвестно. В этом надо разбираться. Заново. Но не через объём газа. Только через тепловую энергию.
Переносчики тепловой энергии — это фотоны инфракрасного диапазона электромагнитных волн. Тогда надо исследовать зависимость количества тепловой энергии данной массы вещества от температуры при постоянном давлении
![]() — удельная теплоёмкость исследуемого вещества.
— удельная теплоёмкость исследуемого вещества.
Считается, что зависимость удельной теплоёмкости от температуры носит нелинейный характер у всех веществ.
Так ли это на самом деле? Рассмотрим, что за физическая характеристика вещества – удельная теплоёмкость.
Удельная теплоёмкость у разных веществ разная и зависит от химического состава.
Удельная теплоёмкость вещества не зависит от температуры. Так как это одно и тоже.
Удельная теплоёмкость – это порция тепловой энергии, при поглощении (излучении) которой, единица массы вещества увеличивает (уменьшает) свою температуру на . Исключение составляет скрытая теплота плавления и кипения. Об этом подробно рассказано в разделе 25 этой главы.
Для определения численного значения температуры учёные изобрели термометры и температурные шкалы.
В чём их смысл? Как уже упоминалось, за основу построения температурной шкалы были взяты два состояния одного вещества – воды. Так, например, Цельсий принял точку таяния льда равной нулю, а точку кипения воды за 100.
Чем отличаются друг от друга эти два состояния одного вещества? Только количеством тепловой энергии.
Этот промежуток между двумя реперными точками он поделил на 100 равных частей. Одну сотую этого интервала он назвал градус Цельсия.
Рассмотрим, что это означало физически?
При температуре , например, каждый грамм воды уже имел определённое количество тепловой энергии. Какое, именно, мы не знаем.
К этому количеству тепловой энергии добавим (нагреванием) на каждый грамм ещё тепловой энергии до состояния кипения воды. Этому количеству добавленной тепловой энергии на каждый грамм воды и соответствует температура .
Одна сотая этого количества тепловой энергии на каждый грамм воды соответствует .
Одновременно эта порция тепловой энергии для каждого грамма вещества является удельной теплоёмкостью.
При поглощении единицей массы вещества количества тепловой энергии, численно равной удельной теплоёмкости, увеличение температуры составит .
Цельсий поделил температурную шкалу на 100 равных частей. На самом деле он разбивал количество тепловой энергии, поглощаемой единицей массы вещества от точки таяния льда до точки кипения воды, на 100 равных частей.
– это одна сотая разницы тепловой энергии от точки кипения воды до точки таяния льда для каждой единицы массы вещества и одновременно – это одна порция тепловой энергии, равная удельной теплоёмкости для данного вещества.
Когда каждая единица массы вещества поглотит (или излучит) количество тепловой энергии численно равной удельной теплоёмкости данного вещества, только тогда температура вещества увеличится (или понизится) на![]() .
.
А также и вне этого участка.
Где же тут нелинейная зависимость?
Удельная теплоёмкость – это порция тепловой энергии. У разных веществ она разная. Эту порцию тепловой энергии назвали удельная теплоёмкость. Но одновременно это является и![]() . Но так как удельная теплоёмкость у всех веществ разная, то эту порцию тепловой энергии удобней называть
. Но так как удельная теплоёмкость у всех веществ разная, то эту порцию тепловой энергии удобней называть![]() .
.
Так как первым и основным веществом при построении температурной шкалы Цельсия была вода, то все начальные единицы измерения, связанные с этим процессом, принадлежали воде и были равны единице. А, именно. При нагревании 1г воды на , поглощённое количество тепловой энергии данной массой воды, назвали 1калория.
Мы нагреваем 1г воды от ![]() до
до ![]() . Тепловая энергия, поглощённая данной массой воды, равна 100кал. При этом одну сотую этого количества вещества тепловой энергии назвали удельная теплоёмкость. Удельную теплоёмкость воды приняли равной
. Тепловая энергия, поглощённая данной массой воды, равна 100кал. При этом одну сотую этого количества вещества тепловой энергии назвали удельная теплоёмкость. Удельную теплоёмкость воды приняли равной ![]() .
.
Как определить удельную теплоёмкость других веществ, кроме воды? Например, меди. Необходимо определить количество тепловой энергии, которое поглотится единицей массы меди от (точка таяния льда) до (точка кипения воды), и поделить на 100. Полученная величина будет являться удельной теплоёмкостью меди. Эта величина, равная количеству тепловой энергии, при поглощении или излучении которой температура единицы массы меди увеличится или понизится на .
Итак, мы рассмотрели физический смысл понятий температурная шкала, удельная теплоёмкость, градус Цельсия.
При поглощении единицей массы вещества тепловой энергии численно равной удельной теплоёмкости температура вещества увеличивается на .
По определению удельная теплоёмкость не может быть нелинейной в зависимости от температуры. Это одно и тоже.
Удельная теплоёмкость величина постоянная у каждого вещества. Тогда почему произошла ошибка?
Нелинейными являются все измерители температуры. Эта нелинейность появляется из-за того, что все измерители температуры основаны на эффектах, при которых происходит изменение физических свойств веществ в зависимости от температуры. А эти зависимости нелинейные.
Это ответ о нелинейности, которую присвоили почему-то удельной теплоёмкости.
Теперь можно дать определение температуры.
Температура отдельного вещества или смеси веществ — это количество порций тепловой энергии, равных удельной теплоёмкости данного вещества или смеси веществ, поглощённой или излученной каждой единицей массы вещества или смеси веществ, и отсчитываемая от точки таяния льда равной .
Разобравшись, что такое удельная теплоёмкость, только теперь можно приступить к поискам абсолютного нуля температуры.
Как определить температуру равную абсолютному нулю?
Необходимо у исследуемой массы вещества отводить тепло. При этом, отведя порцию тепловой энергии численно равную удельной теплоёмкости с каждой единицы массы данного вещества, можно считать, что понижение температуры вещества составило ![]() . И так до тех пор, пока тепловая энергия в данной массе вещества не закончится.
. И так до тех пор, пока тепловая энергия в данной массе вещества не закончится.
Удастся ли экспериментально отводить тепло от данной массы вещества в калориметре, например, от точки таяния льда до абсолютного нуля?
Чтобы построить достоверную температурную шкалу вне промежутка от ![]() до
до ![]() , необходимо с помощью калориметра подводить тепло к исследуемой массе вещества. При этом при поглощении одной порции тепловой энергии, численно равной удельной теплоёмкости, каждой единицей массы данного вещества, можно считать, что повышение температуры составило
, необходимо с помощью калориметра подводить тепло к исследуемой массе вещества. При этом при поглощении одной порции тепловой энергии, численно равной удельной теплоёмкости, каждой единицей массы данного вещества, можно считать, что повышение температуры составило![]() . И так до тех пор, пока данный процесс будет технически возможен. Это и будет являться достоверной температурной шкалой от
. И так до тех пор, пока данный процесс будет технически возможен. Это и будет являться достоверной температурной шкалой от![]() .
.
То же самое необходимо сделать, отводя тепло, для получения достоверной температурной шкалы отрицательных температур. После этих процедур необходимо произвести тарировку шкал всех измерителей температур так, чтобы один градус на их шкалах соответствовал поглощению или излучению тепловой энергии равной одной порции удельной теплоёмкости. Таким образом, так называемая термодинамическая шкала Кельвина ошибочная. Использование шкалы Кельвина – это ошибка.
Используемые источники:
1. Николаев С.А. “Эволюционный круговорот материи во Вселенной”. 6-ое издание,
СПб, 2010 г., 320 с.



 Март 18th, 2012
Март 18th, 2012  admin
admin 

 Опубликовано в рубрике
Опубликовано в рубрике  Метки:
Метки: 
Wow! That’s a really neat ansewr!